Un estudio coliderado por el Instituto de Neurociencias UMH-CSIC descifra las claves genómicas de la atrofia del hipocampo en la epilepsia
9 junio 2021
Genes que se expresan de forma diferente en distintos tipos celulares de una región del hipocampo denominada CA1, implicada en la formación de la memoria, son responsables de la atrofia o esclerosis, asociada a la epilepsia del lóbulo temporal. Esta es la conclusión de un trabajo publicado en Cell Reports, coliderado por el Instituto Cajal del Consejo Superior de Investigaciones Científicas (CSIC) de Madrid y el Instituto de Neurociencias, centro mixto de la Universidad Miguel Hernández (UMH) de Elche y el CSIC.
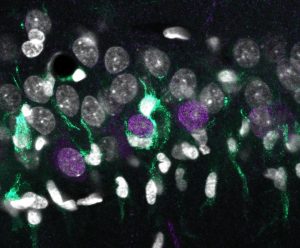
«Acumulación desigual de microglía (turquesa) alrededor de las neuronas superficiales de CA1 (en violeta), rodeados por otros núcleos celulares (blanco). Crédito: Elena Cid, Instituto Cajal»
La investigación, titulada ‘Trayectorias transcripcionales neurodegenerativas específicas para cada subcapa y tipo de célula en la esclerosis del hipocampo’, está liderada por Liset Menéndez de la Prida, del Instituto Cajal del CSIC, y José López-Atalaya, del Instituto de Neurociencias UMH-CSIC. El equipo investigador ha descubierto que esta atrofia se caracteriza por la muerte de una población de neuronas, denominadas piramidales, en la capa superficial de la región CA1 del hipocampo. Además, los investigadores han comprobado que esa muerte celular está asociada a una hiperactivación exagerada de otros tipos celulares residentes en el cerebro como la microglía (sistema inmune del cerebro) y los astrocitos (células que proporcionan soporte y avituallamiento a las neuronas y que, también, están implicadas en funciones clave como el aprendizaje o la memoria).
Tanto la microglía (los macrófagos del cerebro) como los astrocitos se activan en situaciones patológicas, cambiando incluso su morfología, y pueden contribuir a la puesta en marcha de procesos de inflamación asociados a la muerte de las neuronas piramidales. Hasta ahora, se desconocía por qué algunos tipos neuronales son más vulnerables que otros. En este trabajo, los investigadores han desarrollado un mapa genómico que identifica el código genético preciso de todos los tipos celulares implicados en la enfermedad. Según señala Liset Menéndez de la Prida, “los mapas genómicos intentan asignar diferentes genes con elementos biológicos concretos. En el caso del cerebro, se trata de vincular una serie de genes con tipos neuronales específicos como las neuronas, los astrocitos y la microglía. Por su parte, López-Atalaya añade que “hemos visto en modelos de epilepsia en rata y ratón que hay regiones en el hipocampo más vulnerables a la epilepsia desde el punto de vista de la neurodegeneración. Se sabe desde hace poco que la región CA1 del hipocampo tiene una estructura laminar y hemos visto que la capa superficial tiene mayor vulnerabilidad y degenera antes”.
Para llegar a estas conclusiones, han llevado a cabo un detallado estudio que incluye análisis genómicos, histológicos y electrofisiológicos. Estos tres enfoques han permitido ver que la capa superficial de la región CA1 del hipocampo es más vulnerable y tiene más propensión a degenerar que la capa profunda. En concreto, por el perfil de expresión génica de cada célula, han identificado genes que se expresan de manera muy diferente en los distintos tipos celulares de esta región del hipocampo. El investigador De la Prida añade que esos genes implicados en la neurodegeneración “podrían convertirse en nuevas dianas terapéuticas o herramientas diagnósticas”, puesto que la esclerosis o atrofia del hipocampo es clave para el diagnóstico diferencial de la epilepsia del lóbulo temporal, que además es la forma más común de epilepsia resistente a fármacos.
Existen dos procedimientos avanzados para la toma de muestras biológicas: la micro-disección láser de una región del tejido cerebral y el muestreo de núcleos de células individuales extraídos de rata y ratón, junto con técnicas bioinformáticas han permitido identificar las firmas genéticas de la neurodegeneración. “Cuando las neuronas comienzan a degenerar, emiten señales que son captadas por la microglía, las células inmunes del cerebro encargadas de mediar en la respuesta inflamatoria y neurotóxica. Cada uno de estos procesos lleva aparejada la activación o desactivación de determinados programas genéticos, que son los que constituyen la firma genética”, aclara López-Atalaya. Los investigadores registraron la actividad eléctrica de las neuronas individuales y comprobaron que algunas mostraban signos de hiperexcitabilidad, característicos de la epilepsia. Las neuronas hiperexcitables tendían a ser de un tipo determinado (piramidales) y a estar localizadas en la capa superficial de la región CA1 del hipocampo.
La epilepsia del lóbulo temporal no obedece a una sola causa. Puede estar ocasionada por infecciones, lesiones cerebrales provocadas por traumatismos, tumores o factores genéticos diversos que, generalmente, se manifiestan con cambios anatómicos en la organización laminar de la corteza cerebral. Algo común a este grupo heterogéneo de trastornos es el origen de las crisis en el lóbulo temporal asociado con atrofia del hipocampo, valorado mediante resonancia magnética nuclear. El diagnóstico anatomopatológico definitivo se hace después de la cirugía, que extirpa una porción del hipocampo en los casos que no responden al tratamiento farmacológico.
En el Alzheimer, que también afecta a la región CA1 del hipocampo, se han descrito crisis subclínicas (sin manifestación motora) similares electrográficamente a las de la epilepsia del lóbulo temporal. Ambas enfermedades cursan con déficits de memoria episódica. La memoria episódica, que involucra al hipocampo, hace referencia a los acontecimientos personales y autobiográficos significativos asociados a un momento espacial y temporal concreto, como el primer día de colegio o de universidad. En algunos casos de Alzhéimer se aprecia, también, atrofia de hipocampo, por lo que los resultados de este estudio podrían ser de relevancia para las patologías asociadas con el envejecimiento cerebral.
Cid E., Marquez-Galera A., et al. “Sublayer- and cell-type-specific neurodegenerative transcriptional trajectories in hippocampal sclerosis». Cell Reports. DOI: 10.1016/j.celrep.2021.109229



